Лабораторна робота
Визначення швидкості хімічної реакції між натрій тіосульфатом та ферум(III) хлоридом
Мета: виявити як змінюється швидкість проходження хімічної реакції при додаванні в реакцію солей деяких перехідних металів (Cu2+, Co2+)
Теорія
Суть роботи полягає в фіксуванні швидкості реакції між натрій тіосульфатом та ферум(III) хлоридом при наявності солей металів Cu2+, Co2+ на спектрофотометрі. При додаванні натрій тіосульфату до ферум(III) хлориду утворюється нестійкий комплекс темно-синього забарвлення, який згодом знебарвлюється через відновлення йонів Fe3+ до Fe2+
Fe3+ + 2S2O32- = [Fe(S2O3)2(H2O)2]–
2Fe3+ + 2S2O32- = 2Fe2+ + S4O62-
Реакція між тіосульфатом натрію та ферум(III) хлоридом є окисно-відновною.
Окисно-відновна реакція — хімічна реакція, яка відбувається із зміною ступеня окиснення атомів, що входять до складу реагентів, і реалізується перерозподілом електронів між атомом-окисником та атомом-відновником.
Окиснення – хімічний процес, під час якого елемент віддає електрони, при цьому ступінь окиснення елемента підвищується. Елемент, який віддає електрони – відновник.
Відновлення — це хімічний процес, під час якого елемент приєднує електрони, при цьому ступінь окиснення елемента знижується. Елемент, який приєднує електрони – окисник.
А ‒ e– → А+ (процес окиснення)
B + e– → B– (процес відновлення)
A + B → А+ + B– (окисно-відновна реакція)
В реакції даній реакції тіосульфат натрію виступає в ролі відновника, а ферум(III) хлорид – в ролі окисника:
Fe3+ +1e– → Fe2+ окисник / процес відновлення
2S2O32- – 2e– → 2S2O32- відновник / процес окиснення
Каталізатор – це хімічна сполука, що пришвидшує реакцію, але не входить в склад продуктів реакції. Речовина, яка сповільнює реакцію називається інгібітор.
Обладнання та реактиви: ферум(III) хлорид 0,05М, натрій тіосульфат 0,05М, купрум сульфат, кобальт сульфат, штатив з пробірками, піпетки, дозатори, спектрофотометр.
| Хід роботи
Завдання 1
1. Запустити програму Spectra Suite та налаштувати спектрофотометр Ocean Optics за інструкцією.
2. Відібрати з пробірки з написом FeCl3 2 мл розчину та помістити в кювету.
3. Помістити кювету в спектрофотометр.
4. Налаштувати програму для побудови графіку. Для цього натиснути іконку [Strip Chart] . Відкриється діалогове вікно [Chart Trend Settings]. У вкладці [Range Selection] навпроти [One Wavelength] вибрати довжину хвилі 550 нм. Далі натиснути кнопку [Accept], а потім [Close].
5. Після цього відібрати 2 мл розчину з пробірки з написом Na2S2O3 та долити у кювету, яка знаходиться у спектрофотометрі.
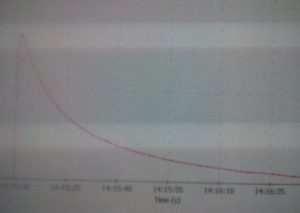
6. Спостерігати за побудовою графіку. Після закінчення реакції за графіком потрібно знайти час початку реакції і порахувати час напіврозпаду комплексу. Для цього необхідно натиснути курсором на найвищу точку на графіку, знизу з’явиться значення оптичної густини та час. Для зручності можна відрегулювати зовнішній вигляд графіка за допомогою таких кнопок . Збільшити графік можна за допомогою кнопки масштабування [Zoom In] . Також можна використати кнопки [Scale Graph to Fill Window] або [Scale Graph Height to Fill Window] для того, щоб розширити графік. Отримане значення оптичної густини потрібно поділити на 2, віднайти на графіку отриману оптичну густину та знайти час, який відповідає даному результату. Записати значення в таблицю 1.
Також потрібно встановити з графіку час (в секундах), при якому оптична густина (D) становила 80%, 60%, 40%, 20% від D на початку реакції. Початок реакції (найвища точка на графіку) приймається за 100%). Занести дані в таблицю 2. Побудувати графік по даних із таблиці 2: вісь Ох – час (в секундах), вісь Oy – оптична густина.
Завдання 2
1. Промити піпетки та кювети.
2. Відібрати з пробірки з написом FeCl3 2 мл розчину та помістити в кювету.
3. Додати до розчину FeCl3 в кювету 1 краплю розчину CuSO4 або CoSO4 (за вказівкою викладача або лаборанта).
4. Помістити кювету в спектрофотометр.
5. Після цього відібрати 2 мл розчину з пробірки з написом Na2S2O3 та долити у кювету, яка знаходиться у спектрофотометрі.
6. Виконати пункт 6, описаний у завданні 1. Занести отримані дані в таблицю 3 і таблицю 4.
7. Зробити висновок про вплив солі купруму(II) або кобальту(II) на швидкість реакції.
|
Спостереження та обрахунки:
Таблиця 1
| Час початку реакції |
Оптична густина |
Час напівроз-паду |
Оптична густина |
| |
|
|
|
Таблиця 2
| % |
t, с |
D |
| 100 |
|
|
| 80 |
|
|
| 60 |
|
|
| 40 |
|
|
| 20 |
|
|
| 1 |
|
|
Таблиця 3
| Час початку реакції |
Оптична густина |
Час напівроз-паду |
Оптична густина |
| |
|
|
|
Таблиця 4
| % |
t, с |
D |
| 100 |
|
|
| 80 |
|
|
| 60 |
|
|
| 40 |
|
|
| 20 |
|
|
| 1 |
|
|
|
| Висновок: |
Запитання:
- Що таке окисник?
- Що таке відновник?
- Чим відрізняються процеси окиснення та відновлення?
- Для чого потрібен каталізатор?








 25 листопада в Інституті біології, хімії та біоресурсів у рамках проекту «МобіЛаб» для учнів Буковинської Малої академії наук було проведено третю лабораторну роботу із циклу «Хімія кольору та миючих засобів».
25 листопада в Інституті біології, хімії та біоресурсів у рамках проекту «МобіЛаб» для учнів Буковинської Малої академії наук було проведено третю лабораторну роботу із циклу «Хімія кольору та миючих засобів». 